| |
联 系 方 式 |
电 话: |
0371-66559606 |
手 机: |
13838271516 |
|
|
PAC产品系列 |
|
|
 |
铁盐系无机混凝剂 |
- 铁盐系无机混凝剂-硫酸铁物
硫酸亚铁(ferrous sulfate,FS),分子式FeSO4·7H20,俗称绿矾,为蓝绿色单斜晶系结晶或颗粒。无臭无味,熔点64℃,加热易失去结晶水。易吸潮,在水中的溶解度随温度升高而增大(0℃,28.8g/100g H2O;100℃,57.8g/lOOg H2O),有腐蚀性,在空气中
放置易被氧化成黄色或黄褐色的碱式硫酸铁Fe(OH)SO4,其水溶液呈弱酸性,亚铁离子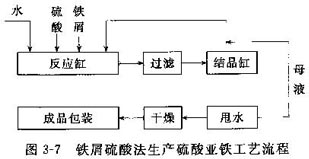 有较强的还原性,易与其他阳离子形成复盐。 有较强的还原性,易与其他阳离子形成复盐。
- 硫酸亚铁制备方法
(1)铁屑硫酸法
由稀硫酸和铁反应生成硫酸亚铁和氢气,并放出热量。反应式如下:
Fe+ H2SO4→FeSO4+H2↑
如图3-7所示,首先将铁屑溶于硫酸中,加热至不再溶解为止(保持金属铁过量),过滤,滤液用硫酸酸化,冷却后通入硫化氢至饱和,放置2-3d,在水浴上加热后过滤,滤液倾入蒸馏烧瓶中,在通入不含氧的二氧化碳的状况下蒸发至一半,然后在二氧化碳气中令其结晶,次日吸滤出结晶,先用水洗,再用乙醇洗,尽快地在30℃下进行干燥,即得硫酸亚铁。
(2)钛白副产法
由钛铁矿制取钛白粉生产中以副产品得到。钛铁矿与硫酸反应时制得Ti(SO4)2和TiOSO4,同时产生FeSO4和Fe2(SO4)3,反应如下:
5H2SO4+2FeTiO3→2FeSO4+TiOSO4+Ti(SO4)3+15H2O
酸解生成的TiOSO4和FeSO4等混合物,经浸取和沉降除去20%左右的不溶性残杂,溶液在除去杂质后加入废铁皮进行还原处理,使溶液中的Fe3+以Fe2+形式存在,TiOSO4以Ti2(SO4)3形式存在。反应如下:
Fe2(SO4)3+Fe→3FeSO4
2TiOSO4+Fe+2H2S04→Ti2(SO4)3+FeSO4+2H2O
经净化还原的钛液,经过真空浓缩冷却,使硫酸亚铁结晶出来,用离心机甩下后取出。不同生产厂家,因工艺和设备不同,所用钛精矿的原料不同,副产硫酸亚铁的杂质含量也不同。
(3)酸洗废液冷却结晶分离法
酸洗时采用20%-25%的稀硫酸。酸洗后的废液中含有15%-20%的硫酸亚铁。利用冷却结晶法将硫酸亚铁分离出来,而含硫酸的母液可返回酸洗槽继续使用,冷却温度为-10-5℃。
(4)硫铁矿还原法
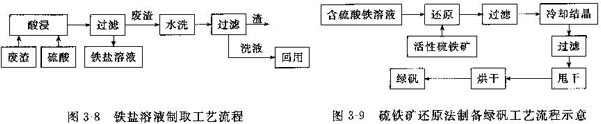
中国专利03103056.4中介绍了一种硫酸亚铁的制备方法。工艺流程图如图3-8和图3-9所示。其主要步骤为:将烘干的硫铁矿烧渣(以质量百分比计,FeO为0.5%,Fe3O4为15.96%,Fe2O3为74.10%)与硫酸(浓度为50%,用量为理论用量的1.1倍)在80-130℃条件下反应,搅拌,使得烧渣均匀分布于反应液中,反应4h后得到含硫酸铁的酸性溶液,然后在含铁浓度为0.5-4mol/L的硫酸铁的酸性溶液中加入硫铁矿或硫精矿(液固比为100ml:8g),搅拌,反应温度为100℃,得到硫酸亚铁溶液,再经-10-20℃冷却结晶、过滤、甩干,于40--80℃烘干得到七水硫酸亚铁(FeSO4·7H2O),即绿矾。此法工艺简单、反应温度低、反应速度快,降低了硫酸亚铁生产成本。
- 硫酸亚铁应用特点
硫酸亚铁用于原水、地下水和工业给水的净化处理,使用时需先将其调配成5%-10%的溶液后计量投加,最佳混凝pH值范圈为6-81;硫酸亚铁适用了碱度高。浊度高的废水处理,受水质影响,适宜pH值为8.1-9.6,最好与碱性药剂或有机高分子絮凝剂联合使用。
由于Fe2+会使处理后的水带色,特别是当Fe2+与水中有色胶体作用后,将生成颜色更深的溶解物,故采用硫酸亚铁做絮凝剂时,需采用氯化、曝气等方法,目前有两种原水处理的情形可以使用FeSO4作混凝剂:一是加氯氧化,不仅可以提高通氯杀菌效率,而且可以在较宽的pH值范围内氧化Fe2+,使硫酸亚铁有效地对胶体颗粒起絮凝作用;二是石灰法软化原水并采用通氯杀菌的工艺时,投加FeSO4作絮凝剂效果明显改善。
Fe2+氧化成Fe3+后,其混凝作用机理也就与铝盐和氯化铁基本相同,差别仅仅在于铁盐或亚铁盐(氯化铁除外)适用的pH值范围(4.0-11.0)较硫酸铝的(5.5-6.5)为宽。
- 铁盐系无机混凝剂-三氯化铁
三氯化铁(ferric chloride,FC),分子式FeC13·6H2O,黑棕色结晶,大部分是薄片状,属于六方晶体系。液体产品为红棕色溶液,相对密度2.898,熔点306℃,分解温度315℃,沸点下大部分分解。400℃的蒸汽含Fe2Cl6分子,750℃的蒸汽含FeCl3分子。极易吸潮,可生成2水合物、2.5水合物、3.5水合物、6水合物。易溶解于水(0℃,74.4g/100g H2O;100℃,5.7g/100g H2O),溶液呈强酸性,三氯化铁水溶液稀释时,能水解生成棕色絮状氢氧化铁沉淀。
- 三氯化铁制备方法
固体产品采用废铁屑氯化法、低共熔混合物反应法和四氯化钛副产法,液体产品多用铁屑盐酸法和一步氯化法。
(1)废铁屑氯化法
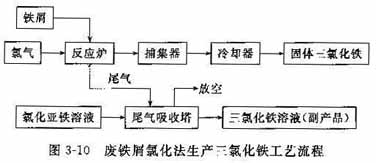
以废铁屑和氯气为原料,工艺流程如图3-10所示,在一立式反应炉内反应,生成的三氯化铁蒸气和尾气由炉的顶部排出,进入捕集器,经冷凝即得成品。反应尾气中有少量未反应的氯气和三氯化铁,用氯化亚铁溶液吸收氯气,可得液体三氯化铁。其反应方程式如下:2Fe+3Cl2→2FceCl3
(2)低共熔混合物反应法
在一个带有耐酸衬里的反应器中,令铁屑和干燥氯气在三氯化铁与氯化钾或氯化钠的低共熔混合物(例如70% FeCl3和30% KCl)内进行反应。首先,铁屑溶解于共熔物(600℃)中,并被三氯化铁氧化成二氧化铁,后者再与氯气反应生成三氯化铁,升华后被收集在冷凝室中,该法可制得纯度较高的三氯化铁。
(3)三氯化铁溶液的制备
在盐酸中分次加入铁屑。反应完毕后,将溶液在一定的温度下过滤,制得氯化亚铁溶液,再通入氯气直至全部氧化为氯化高铁。将氯化高铁溶液蒸发至相对密度为1.659,冷却即为氯化高铁。
(4)硫酸渣吸收含氯废气
中国专利200510200706.3“硫酸渣吸收含氯废气制备三氯化铁”中介绍了一种硫酸渣吸收含氯废气制备三氯化铁的工艺,工艺流程如图3-11所示,以含铁量30%-60%的硫酸渣和含氯废气为原料,在吸收塔中反应而得。此工艺将硫酸渣的综合回收和含氯废气治理合二为一,达到了“以废治废、综合治理、变废为宝”的目的,且省去了传统三氯化铁生产的氯化、氧化工序,节约资源,并解决了盐酸的来源问题。含氯废气的吸收率达90%以上,可实现达标排放,实现了无污染的清沽生产。
具体制备方法如下,取硫酸渣(含铁60%,过60目)与若干水配成硫酸渣矿浆,由喷射装置进入吸收塔,含氯废气(100L/h,含氯化氢和氯气量为 356mg/m3)从反应塔下部进入,在吸收塔内与硫酸渣矿浆逆流接触,85℃时循环吸收4h,烟气中的Cl2和HCl与硫酸渣反应,将Cl2和HCI除去,得到的由三氯化铁、硫酸渣和水组成的混合物从吸收塔流出,经过滤可实现水溶性的三氯化铁与渣的分离,得到水溶性的三氯化铁,然后对三氯化铁溶液进行净化和去除重金属,再进行过滤得到比较纯净的三氯化铁溶液,经蒸发浓缩可得到固体三氯化铁,尾气可直接排放。 356mg/m3)从反应塔下部进入,在吸收塔内与硫酸渣矿浆逆流接触,85℃时循环吸收4h,烟气中的Cl2和HCl与硫酸渣反应,将Cl2和HCI除去,得到的由三氯化铁、硫酸渣和水组成的混合物从吸收塔流出,经过滤可实现水溶性的三氯化铁与渣的分离,得到水溶性的三氯化铁,然后对三氯化铁溶液进行净化和去除重金属,再进行过滤得到比较纯净的三氯化铁溶液,经蒸发浓缩可得到固体三氯化铁,尾气可直接排放。
- 三氯化铁应用特点
三氯化铁是铁盐混凝剂中最常用的一种。可用于饮用水及工业给水净化处理,具有易溶于水,矾花大而重,形成的絮体比铝盐密实,沉淀性能好,对温度、水质及pH值的适应范围宽等优点,液体产品可直接计量投加,固体产品需在溶解池调配成10%-20%溶液后计量投加。固体产品吸湿性极强,开封后最好一次性配成溶液,有效投加浓度一般在10-50mg/L。产品腐蚀性强,投加设备需进行防腐处理,操作工人应配备劳动保护设施。
三氯化铁可用以去除水的色度,最适宜pH值为6.0-8.4,但在6.0-11.0范围内均可使用。三氛化铁水解过程会产生H+,降低水的pH值(为3.5-5.0),因而一般需要投加石灰做助剂,三氯化铁还可用于活性污泥脱水。使用的pH值范围为6.0-11.0,最佳的pH值范围为6.5-8.4。通常的用量为5-100mg/L。形成的絮凝体粗大,沉淀速度快,不受温度的影响。用它来处理浊度高的废水,效果更显著。它的腐蚀性大,比硫酸亚铁的腐蚀性强,能腐蚀混凝土和使某些塑料变形。当它溶解于水时,产生氯化氢气体,污染周围环境。三氯化铁不仅可做絮凝剂,也可做防水剂等。
三氯化铁可与阴离子聚丙烯酰胺组合使用,提高污泥调质效果,降低污水处理费用,也可以与聚合氯化铝组合使用。
在污泥调质中,能产生大而重的絮体。对于混合污泥来说,其加药量一般为2%-6%,要求相应的石灰投加量为20%-40%,消化污泥的石灰投加量一般为10%-20%。
- 铁盐系无机混凝剂-高铁酸盐
高铁酸盐(ferrate)是铁的六价化合物,指高铁酸根(FeO24-)的金属盐类。目前合成的高铁酸盐包括Na2FeO4、K2FeO4、Li2FeO4、Cs2FeO4、Ag2FeO4、CaFeO4、MgFeO4、SrFeO4、BaFeO4、ZnFeO4等。高铁酸盐一般为深紫色固体,溶液具有特定紫色,最大吸收波长为510nm,摩尔吸光系数为1030L/(mol·cm),另外高铁酸根离子在786nm处还有一个吸收峰,也是其特征吸收峰。高铁酸盐在干燥条件下,230℃开始分解。
高铁酸盐中最重要的化合物为高铁酸钾。高铁酸钾固态为黑紫色粉末,极易溶于水,形成深紫色溶液,不溶于乙醚、醇和氯仿等有机溶剂,熔点198℃。
- 高铁酸盐制备方法
迄今为止,人们在实验室已经成功合成了多种高铁酸盐。理论上,高铁酸根能够与多种阳离子形成盐,也可与SO24-、SiO24-等相似M-O结构酸根等形成M(Fe,X)O4形式的复合盐,但由于有些高铁酸盐的稳定性极低,制备和储存条件苛刻,实际上制备出有实用意义的高铁酸盐种类并不多,多数情况下合成高铁酸钾或高铁酸钠。一般固体生产高铁酸钾,因为高铁酸钠在碱溶液中的溶解度大,多制备高铁酸盐溶液。高铁酸盐的制备工艺可以分为熔融法、电解法和次氯酸盐氧化法三类。
(1)熔融法
熔融法又称干法,其制备高铁酸盐的原理是将反应物置于熔融状态下以制备高铁酸盐,避免在水溶液中制备高铁酸盐时由于高铁酸盐自分解造成的损失,干法制备高铁酸盐包括两大类方法。
第一种是利用KNO3或KNO2与碱金属在高温熔融状态下氧化单质铁或氧化铁制备。举例来说,可以在贫氧条件下将单质铁、硝酸钾与碱金属氢氧化物的颗粒状混合物置于高温下制得高铁酸盐;也可将碱金属硝酸盐或碱金属亚硝酸盐与Fe2O3、Fe3O4等铁氧化物混合,将反应物加热至780-1100℃制得高铁酸盆。升温过程、反应物摩尔比及投料顺序是影响干法产品收率和纯度的关键因素。
第二种利用过氧化物在碱性高温条件下氧化铁盐或铁的氧化物制备高铁酸盐。过氧化物可选用过氧化钠或过氧化钾。以Na2O2与FeSO4为例,将Na2O2、FeSO4在密闭、干燥的环境中混合,加热到700℃反应1h,得到含Na2FeO4的粉末。反应产物用NaOH溶解,过滤除去不溶物。向滤液中加入KOH固体至饱和,过滤获得高铁酸盐晶体。
其反应机理可能是经烧结后的反应产物是生成了四价铁的铁酸盐,溶于水后发生歧化反应生成了六价的高铁酸盐及三价铁的水合氧化物,也可能是在熔融反应时直接生成了Na2FeO4。如下式所示:
3Na2FeO3+5H2O→2Fe(OH)3+Na2FeO4+4NaOH
2FeSO4+6Na2O2→2Na2FeO4+2Na2O+2Na2SO4+O2
(2)电解法
电解氧化法制备高铁酸钾的原理是通过电解过程在阳极上发生氧化反应,使铁或铁离子氧化成高铁酸根,再以此为前驱物制备高铁酸钾等盐类。一般利用膜式电解池,采用离子交换膜,阳极为铁或氧化铁,阴极为铂等惰性材料。电解过程通常在强碱性介质中进行,也可以在阴极池中充入NaOH溶液,阳极池中充入NaCl和三价铁盐,通过电解三价铁制备高铁酸盐溶液。离子交换膜的作用是阻止生成的高铁酸盐渗透到阴极室发生还原反应而分解。电解法制备高铁酸盐的装置如图3-12所示。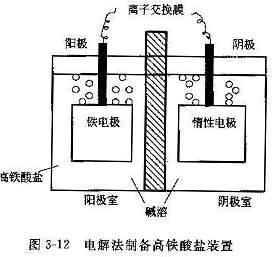
电极反应如下:
阳极反应:Fe3+ +8OH- →FeO24- +4H2O+3e
或Fe+8OH- →FeO24- +4H2O+6e
阴极反应:2H2O+2e→H2+2OH-
总反应:2Fe3+ +10OH- →FeO24- +2H2O+3H2↑
或Fe+2H2O+2OH- →FeO24- +3H2O↑
从阳极反应可以看出,生成高铁酸盐的同时消耗OH-,在阴极室则生成H2+的同时产生OH-。阴极室产生的OH-通过离子交换膜扩散至阳极室,可以补充阳极的消耗,保证电解过程持续进行。电解液可采用NaOH或KOH溶液,浓度在14-l6mol/L之间,适当升温有利于电解反应进行,考虑到高铁酸盐易分解,温度不宜高于30℃。阴极产生的风可以还原高铁酸盐,而且气泡附着在阴极表面,降低有效电极面积,必要时用N2吹脱阴极室产生的H2。
电解法制备高铁酸盐是以电能转化为化学能获得产物的过程,保证较高的电流效率是该方法的首要条件。影响电流效率的主要因素有电极组成和结构、电解液成分和浓度、电流密度、电解池温度等。
(3)次氯酸盐氧化法
次氯酸盐氧化法又称为湿法,其制备高铁酸盐的基本原理是利用次氯酸盐在浓碱溶液中氧化三价铁生成高铁酸盐。在碱性条件尤其是强碱性条件下,高铁酸盐的氧化还原电位最低,易于氧化反应进行,在此条件下高铁酸盐最稳定,可以保证获得最大的转化率。反应过程为:2Fe3+ +3ClO- +100H- →2FeO24- +3Cl- +5H2O
实验室合成高铁酸钾的主要步骤包括:a.在冷却状态下,向浓碱溶液中通入氯气,制备饱和的次氯酸盐溶液,过滤去除结晶沉淀后备用;b.在冷却条件下,按比例将三价铁原料与次氯酸盐溶液完全混合,持续搅拌和保持低温(一般低于35℃),待反应完全后即获得高铁酸盐溶液或结晶和溶液的混合物;c.固液分离(也可以进一步纯化),经干燥获得高铁酸钾固体。基本工艺如图3-13所示。
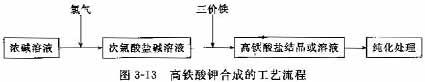
碱可以选用NaOH或KOH,也可采用两者混合溶液采用KOH的合成方法可以通过氧化反应一次合成高铁酸钾沉淀,固液分离干燥即可制得高铁酸钾固体,制得的高铁酸钾固体含有一定量的无机盐,采用NaOH可以制得更高纯度的高铁酸钾成品,由于在水处理工艺中,高铁酸盐一般与其他物化处理药剂联用,本身投药量很低((1-5mg/L),直接氧化法制备的高铁酸盐纯度已能满足要求。铁原料可以选择硝酸铁、氯化铁、氢氧化铁等。
次氯酸盐氧化法制备高铁酸盐氧化反应的最优条件为:
反应温度20-30℃;
反应时间1.5-2h;
次氯酸盐浓度>8mol/L;
碱溶液浓度>40%(质量分数);
铁盐浓度40%-50%(质量分数);
ClO-与铁的摩尔比1.5:1。
次氯酸盐氧化法相对于熔融法和电解法来说,生产成本较低,设备投资少,制备条件容易达到,铁转化率高,是一种很有工业化前途的制备工艺。
- 高铁酸盐应用特点
高铁酸盐是一类强氧化剂,标准氧化还原电位为2.20V(高于臭氧的标准氧化还原电位为2.08V),实际应用一般合成其钠盐或钾盐(Na2FeO4、K2FeO4),高铁酸盐在水中还原后生成新生态羟基氧化铁,最终形成氢氧化铁胶体沉淀,这个特性使它同时具有氧化、絮凝双重水处理功能,理论上是一种较理想的用于污水物化处理的无机药剂。
①使用高铁酸盐首先需要注意其稳定性,现场储备高铁酸盐必须保证环境干燥。事实上,高铁酸盐固体在干燥条件下相当稳定,可保证至少一年不会分解。使用时采用干粉投加的方式,则不用考虑高铁酸盐分解的问题。高浓度高铁酸盐溶液(1%)可保持在4-8h内分解率低于10%。因此,如需投加高铁酸盐溶液,最好采用随配随用的方式。
②投量范围宽,可在1-5mg/L内根据需要选择,特殊情况下,也可投加l0mg/L以上的高铁酸盐。
③高铁酸盐在地表水中褪色速度快,在水处理工艺过程中一般不会出现残留现象,需要与常用混凝剂联用,一般不考虑采用单纯高铁酸盐处理,这是出于成本考虑,同时,单纯高铁酸盐处理时絮体细小,形成缓慢,固液分离效率低于聚合硫酸铝混凝沉淀。
④高铁酸盐用于饮用水处理可以高效氧化分解有毒有害的有机污染物、灭活并强化去除瑚泊水库水中滋生的藻类、杀灭病毒细菌、吸附共沉重金属离子、提高混凝效率,能够全面提升饮用水水质。高铁酸盐在给水处理上的应用不需要改变现有工艺流程,不需增加大的设备。特别适合季节性水质恶化时的强化处理。水处理厂一般采用预氯化作为水质恶化时的应急手段,但氯化过程会生成三卤甲烷、卤乙酸等强致癌有机物,对饮用水安全造成危害,如采用高铁酸盐取代氯化,则能够避免上述问题。
⑤高铁酸盐对含藻湖泊、水库水的强化除藻效果明显,特别是难处理的含藻水的强化混凝。根据试验结果,高铁酸盐预氧化可以将湖泊水藻类去除率提高20%-50%,同时大幅消减混凝剂投量,降低处理成本。
⑥因为在酸性条件下高铁酸盐不稳定,自分解严重,氧化性不能得到全部发挥,实际中如原水pH值过低,应调至中性或弱碱性。
与臭氧、活性炭等除污染技术对比,高铁酸盐在投资、运行费用及操作管理等方面具有明显优势,随着水质标准日趋严格,高效多功能的水处理药剂将占有更大的市场,高铁酸盐的应用前景广阔。
- 铁盐系无机混凝剂-聚合硫酸铁
1974年日本铁矿业株式会社首先取得聚合硫酸铁(polyferric sulfate,简称PFS)制备的专利。欧美等国都相继开发应用了相似的产品。我国于20世纪80年代初期,由天津化工研究院、冶金部建筑研究院先后研制成功并推广使用。近年来,各国在PFS的研究、制备和应用等方面,都取得了很大进展。目前市场上供应的PFS有液体和固体两种形式,液体聚合硫酸铁产品为红褐色或深红褐色的黏稠液,固体产品为淡黄色或浅灰色的树脂状颗粒。
- 聚合硫酸铁物化性质
聚合硫酸铁分子式[Fe2(OH)n·(SO4)3-n/2]m,n<2,m=f(n),又称聚铁或硫酸聚铁。
液体产品相对密度(20℃)>l.45g/cm3,黏度度(20℃)>1lmPa·s。
产品在储运和使用过程中,对设备基本上无腐蚀作用。
- 聚合硫酸铁制备方法
PFS制备方法因原料来源和催化反应方式的不同而有所差异,一般先选用合适的废铁屑或酸洗废液等制备硫酸亚铁,再经氧化聚合反应合成聚合硫酸铁液体产品。按照氧化方式的不同,PFS的制备方法可分为两大类:直接氧化法(即采用强氧化剂如H2O2等直接氧化)和催化氧化(即在催化剂NaNO2等的催化作用下,利用空气或氧气氧化再用硝酸或亚硝酸钠等作催化剂)。
(1)H2O2直接氧化法
将FeSO4和H2SO4混合搅拌升温至50℃,缓缓加入H2O2直至将二价铁氧化为三价铁即制得聚铁产品,此法生产简单,但由于双氧水见光易分解,导致其使用率下降,因而成本较高。
(2)氯酸钾氧化法
氯酸钾是一种氧化剂,在酸性介质中其氧化性更强,氧化反应式:
6FeSO4 +KClO3+3H2SO4→3Fe2(SO4)3+KCl+3H2O
该法制备工艺简单,反应相对温和,氧化剂用量少,且无有害气体产生,但氯酸钾价格昂贵,生产成本高,而且钾盐杂质的夹入也影响产品质量。
(3)亚硝酸钠催化氧化
往反应釜中加入一定量的硫酸亚铁和硫酸水溶液,边搅拌边加入亚硝酸钠,同时通入足够的空气。亚硝酸钠分多次加入,其投加量占物料总量的1.5%,反应时间为17h左右。该法是一种传统的生产方法,工艺简单、反应相对温和,但氧化时间长,催化剂的价格高、用量大,反应时还伴有氮氧化物的排出而造成环境污染,此外由于亚硝酸钠的毒性而限制了该法的推广使用。
(4)硝酸催化氧化
将一定量的硫酸亚铁、硫酸、硝酸和水加入反应釜中搅拌,控制反应温度在60-90℃,同时通入空气进行氧化。硝酸用量约为物料总量的4.0%,反应时间5h左右。由于硝酸价格较低,对人畜毒性较低,制得的聚铁可用于工业废水、生活用水等的净化处理,但是硝酸用量大,生产过程伴随氮氧化物的排出而污染环境。
反应原理如下:
Fe+H2SO4→FeSO4+ H2↑
6FeSO,4+3H2SO4+2HNO3→3Fe2(SO4)3+4H2O+2NO↑
2NO+O2→2NO2
2FeSO4+NO2+H2SO4→Fe2(SO4)3+NO↑+H2O
总反应方程式:
4FeSO4+O2+(2-n)H2S04→2Fe2(OH)n(SO4)3-n/2+2(1-n)H2O
mFe2(OH)n(SO4)3-n/2→[Fe2(OH)n(SO4)3-n/2]m
式中,m=f(n)。
例如:以铁屑,铁矿粉或铁矿熔渣粉为原料,与硫酸反应生成硫酸亚铁,然后再通入O2和硝酸(作催化剂)进行聚合,生成液体PFS。该法的生产流程如图3-14所示。
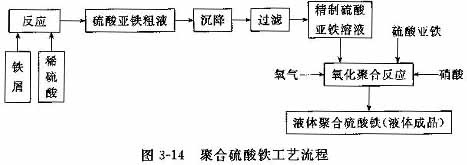
PFS固体产品,一般由液体聚铁经喷雾干燥制得,也有在氧化聚合反应后经调聚、固化、陈化、粉碎等工艺制备。
(5)反应塔法
目前国内多采用反应釜法生产聚合硫酸铁,存在反应周期长,设备腐蚀严重,日常维修任务重等缺陷。针对上述问题,山东建筑工程学院提出了反应塔生产聚合硫酸铁新工艺,用于生产,取得了良好的效果。
根据氧气氧化硫酸亚铁反应的特点,采用了耐腐蚀材料制成的反应塔,利用混合液在塔内流动时形成的巨大比表面积,加强气体的吸收,从而加快反应速度。利用反应塔进行生产既可以在常压,也可以在加压条件下进行。反应方程式为:
4FeSO4+(2-n)H2SO4+O2→2Fe2(OH)n(SO4)3-n/2+
2(1-n)H2O+mFe2(OH)n(SO4)3-n/2→[Fe2(OH)m(SO4)3-n/2]m
式中,0<n<2,m=f(n)。
聚合硫酸铁的生产过程如下:按比例将硫酸亚铁、硫酸和水加入溶解槽中,升退至硫酸亚铁溶解后,注入储罐,用耐腐泵将溶液打入反应塔内,调节液体流量,同时向塔内加入氧气和催化剂,混合液即发生催化氧化聚合反应;生产过程中不断对溶液中的亚铁离子进行监测,等亚铁离子完全氧化后,反应结束,将液体聚合硫酸铁成品用泵打入成品池。反应后剩余的催化剂和氧气可以留待下次生产继续使用。
- 聚合硫酸铁应用特点
PFS是一种碱式硫酸盐,在此溶液中含有大量的[Fe2(OH)3]3+、[Fe3(OH)6]3+、[Fe8(OH)20]4+等高价多核聚合铁络合离子,它们具有很强的中和悬浮颗粒上电荷的能力,降低胶团电位,并水解成絮状羟基铁化合物。它具有较大的比表面积以及较强的吸附能力,与常用的混凝剂三氯化铁、硫酸铝以及聚合氯化铝相比,它有许多明显的优点,如净水过程中的生成矾花大、强度高、沉降快,在水溶液中,残留的铁比三氯化铁少;在污水处理时对某些重金属离子以及COD、色度、恶臭等均有显著的去除效果,对处理水的pH值适应范围广(pH=4-11),且PFS溶液对设备的腐蚀性小,因此许多国家都在研制和应用PFS。
- 铁盐系无机混凝剂-聚合三氯化铁
聚合氯化铁(polyferric chloride,简称PFC),化学式:[Fe2(OH)nCl6·H2O]m,其相对密度为1.450,酸性,易溶于水,外观为黄褐色、黑褐色或黑色透明液体。
- 聚合氯化铁制备方法
聚合氯化铁(PFC)也是无机高分子混凝剂的主要品种之一,尽普在实验室中的制备研究已有大约20年的历史,并在一些方面显现优势,但一直未能在生产实践中推广应用,其原因在于PFC的混凝效果相对于聚合铝仍然较差。人们尝试在PFC的制备过程中加入一定量的添加剂(通常是磷酸盐类),来制得稳定性高达一年以上的产品。
(1)氯化铁法
将定量的六水氯化铁FeCl3·6H2O在高温炉中加热至280-320℃,分解一定时间(例如10min),取出,冷至室温,加入适量去离子水充分搅拌得到聚合氯化铁。
此外将一定配比的六水氧化铁和磷酸氢二钠(Na2HPO4·12H2O)一起研磨,搅拌均匀后置于高温炉中加热至280-320℃,分解 10min,加水搅拌,可得到含一定量磷酸根的聚合氯化铁。亦称聚磷氯化铁,简称PPFC。PO34-对聚合铁有增聚作用,但有一最佳范围,超出范围絮凝效果下降。实验证明,当Fe3+/PO34-摩尔比为14时最佳。
(2)氯化亚铁法
以FeCl2为原料时,需要先将FeCl2氧化成FeCl3,氧化方式有催化氧化法和直接氧化法。催化氧化法即在催化剂(如NaNO2、 HNO3等)的作用下,利用空气或氧气将亚铁离子氧化为铁离子。空气氧化反应极其缓慢,使用催化剂NaNO2可以加快反应速度,但是总的反应时间仍长达10多小时,而且催化剂使用量大,生产效率低,反应过程中排放的氮氧化物会对环境造成污染。为克服以上不足,国内外普遍采用在一定温度和压力下直接通入纯氧进行氧化的方法制备。加热加压和提高氧气浓度可使反应缩短至数小时。但是,此法对设备的要求高、技术难度大,增加了生产成本。
(3)酸洗废液法
以钢铁盐酸酸洗废液为原料,其组成一般为Fe含量150-160g/L,HCl含量60-65以L,将洗液加入配料槽。按HCl/Fe(质量比)等于0.45-0.55配料要求加入铁屑或者盐酸,然后送入聚合釜,并加入适当稳定剂(无机酸)和催化剂(NaNO2),通氧气进行反应,压力为5000-8000Pa(表压),反应温度10-70℃(自然升温,反应2h即得产品)。
- 聚合氯化铁应用特点
PFC具有以下优点:a.对水温变化不敏感,这在水处理工业中是非常重要的;b.聚合氯化铁溶液中含有大量阳离子,可高水平发挥吸附、电中和的混凝作用;c.聚合氯化铁具有一定的盐基度,其酸性低于氯化铁溶液,腐蚀性相对较弱;d.PFC在水处理过程中混凝反应迅速、絮体沉降速度快。
- 巩义市泰和水处理材料有限公司专业生产聚合氯化铝、碱式氯化铝、硫酸铝、硫酸亚铁、聚合氯化铝铁、三氯化铁、硫酸铁、各种无机盐类絮凝剂、无机铁盐、铝盐、助凝剂聚丙烯酰胺等净水药剂的专业厂家。
|
|
|
|