| |
联 系 方 式 |
电 话: |
0371-66559606 |
手 机: |
13838271516 |
|
|
PAC产品系列 |
|
|
 |
胶体的稳定性与凝胶 |
- 所谓“胶体稳定性”,是指胶体颗粒在水中长期保持悬浮分散状态而不聚集下沉的特性。从胶体化学角度而言,憎水胶体并非绝对稳定系统,但从水处理角度而言,聚集沉淀速度很慢的胶体颗粒,仍作为稳定系统。胶体的稳定性分为动力稳定性和聚集稳定性两种。
- 胶体动力稳定性
动力稳定性是指胶粒由于布朗运动而无法下沉的特性。由于水分子热运动撞击胶粒而形成的布朗运动,其平均位移按爱因斯坦(Einstein)和斯莫鲁霍夫斯基(Smoluchowski)的理论,按下式计算:-X=√RT/N*△t/3πμr
式中,-X为平均位移;△t为观察的间隔时间;μ为水的钻度;N为阿伏伽德罗常数;R为气体常数;T为水的热力学温度;r为颗粒半径。由上式可知,胶体颗粒半径越大,布朗运动的摆动幅度即平均位移越小,反之亦然。粒径在3-5μm范围内的颗粒,每秒的平均位移仅在1mm以下;当粒径大于5μm时,实际上布朗运动已经消失,因为大颗粒所受来自不同方向水分子撞击力几乎相互抵消。失去布朗运动的颗粒可在重力作用下下沉,称动力学不稳定。布朗运动剧烈的小颗粒(如胶体),一方面所受重力小,另一方面由于布朗运动的摆动幅度很大,因而能均匀地分散在溶液中,称动力稳定。如果要使胶体颗粒沉降,唯有使胶体颗粒相互凝聚成大的聚集体才行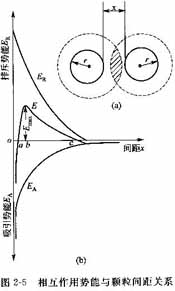 。 。
- 胶体颗粒的聚集稳定性-DLVO理论
带同性电荷胶体颗粒之间由于静电斥力或水化膜的阻碍而不能相互聚集的现象,称“聚集稳定性”。不难理解,若胶体颗粒失去聚集稳定性,就可在布朗运动作用下碰撞聚集,动力学稳定性也就随之破坏,沉淀就会发生。因此,胶体稳定性,关键在于聚集稳定性。DL-VO理论对于胶体的聚集稳定性及其凝聚所作的理论阐述,至今仍具有重要意义。
DLVO理论是由苏联的德加根(Derjaguin)、兰道(Landau)和荷兰的伏维(Ver-wey)、奥伏贝克( Overbeek)分别提出的胶粒相互作用理论,故简称DLVO理论。
DLVO理论认为,两个胶体离子相互接近至双电层发生重叠时,便产生了静电排斥力,见图2-5。同时,两个颗粒之间又存在van der Waal,引力排斥力和吸引力均与胶粒表面间距相关。用势能表达,排斥势能(Er)和引力势能(EA)随颗粒间距的变化可用曲线表示,系统能量的变化是吸引势能加上排斥势能的总和(E=EA+Er),见图2-5。按照一般习惯,横坐标上部为正号,表示排斥力,下部为负号,表示van der Waal引力。由图可知,当两个微粒的距离较远时,只有吸引力起作用,此时,总势能为负值,随着微粒间距离的缩短,排斥力开始起作用,总势能逐渐上升为正值,与此同时,微粒间的吸引力也随着距离的缩短而迅速增加。当距离继续缩短,达到一定范围时,吸引力又占优势,总势能骤然下降。在总势能的b处出现一个能垒,表示此时总势能达到最大值,当胶体微粒的碰撞能小于此能垒时,它不能克服微粒间的排斥力,此时微粒不可能接触,所以也不能产生凝聚作用。这就说明胶体和悬浮液在一定时间内稳定的原因。如果胶体微粒的碰撞能被大,可以克服微粒间的排斥能而超越能垒Emax,这时又由于距离靠近,吸引能Ea随着距离的缩短而激增,此时吸引能占优势。总势能又下降为负值,这时两个微粒发生凝聚作用,这说明悬浮液和胶体出现不稳定的原因。当总势能能垒Emax降低时,部分碰撞可能出现,此时悬浮液或胶体发生慢速凝聚。如果能垒全部消失,微粒间的静电排斥力和van der Waals引力相等,就发生快速凝聚,凝聚速度完全取决于微粒间的碰撞频率。现将DLVO理论的两种作用分别论述于后。
- 微粒间的van der Waals吸引能
分子之间的van der Waals吸引作用,指的是以下3种涉及偶极子的长程相互作用:a.两个永久偶极子之间的相互作用;b.永久偶极子与诱导偶极子间的相互作用;c.诱导偶极子之间的色散相互作用。
上述三种相互作用能全是负值,即表现为吸引,其大小与分子间距距离的六次方成反比。除了少数的极性分子之外,对于大多数分子,色散相互作用在三类作用中占支配地位。
胶体粒子可以看作是大量分子的集合体。Hamaker假设,粒子间的相互作用等于组成它们的各分子对之间的相互作用的加和,对于两个彼此平行的平板粒子,得出单位面积上的相互作用能为:Ea=-A/12πD2
式中。D为两板之间的距离,A为Hamaker常数,它与组成离子的分子之间的相互作用参数有关,因此是物质的特征常数。
对于同一物质的半径为r的两个球形粒子,它们之间的相互作用能为:Ea=-Ar/12H
式中,H为两胶粒之间的最短距离。
上面两个公式适用于离子的大小比粒子间的距离大得多的情形,实际胶体的多数情况符合此要求。若粒子很小,则必须考虑球半径的校正,相应的公式变为:
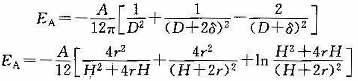
Hamaker常数A是个重要的数量,它直接影响Ea的大小。计算A有两种方法,一是所谓微观法,即从分子的性质(例如极化度、电离能等)出发,计算微粒的A值;另一种是宏观法,即将微观及介质看做是连续相,自它们的介电性质随频率的变化得出。表2-1列出了一些常见物质的Hamaker常数。由于用不同的方法所得的结果不同,故列出的A值有一定的范围,这说明Hamaker常数的准确计算和实验测定仍是一个有待解决的问题。A具有能量单位,一般物质的Hamaker常数约在10^-20J。式(Ea=-A/12πD2)和式(Ea=-Ar/12H)表示的是两微粒在真空中的相互吸引能,对于分散在介质中的微粒,上述两式中的A必须用有效Hamak-er常数代替。对于同一种物质的两个微粒:A131=(A1/2 11 - A1/2 33)2 式中,A131是微粒在介质中的有效Hamaker常数;A11和A33分别是微粒和介质本身的Hamaker常数。公式表明,同一种物质的微粒间的van der Waals作用永远是相互吸引,介质的作用使此吸引力减弱。介质的性质与微粒的性质越接近,则微粒间的相互吸引就越弱。
一些物质的Hamaker常数 表2-1
物质 |
宏观法A/10^-20J |
微观法A/10^-20J |
物质 |
宏观法A/10^-20J |
微观法A/10^-20J |
水 |
3.0-6.1 |
3.3-6.4 |
石英 |
8.0-8.8 |
11.0-18.6 |
离子晶体 |
5.8-11.8 |
15.8-41.8 |
烃类化合物 |
6.3 |
4.6-10 |
金属 |
22.1 |
7.6-15.9 |
聚苯乙烯 |
5.6-6.4 |
6.2-16.8 |
- 双电层的静电排斥作用能
带电的离子和双电层中的反离子作为一个整体是电中性的,因此,只要彼此的双电层尚未交联,两个带电粒子之间并不存在静电排斥力。只有当离子接近到它们的双电层发生重叠,改变了双电层的电位与电荷的分布,才产生排斥作用。
对于两个彼此平行相距D的平板粒子,其双电层在单位面积上的相互排斥能为:

式中,n为反离子浓度,离子数/cm3;K为Bolzmann常数;T为绝对温度;k为离子层厚度的倒数,其单位是长度的倒数;e为元电荷,e=(1.60217733±0.00000049)*10^-19 C;δ0为平衡条件下粒子的表面电位。
由式可知,排斥势能只通过r与δ0发生关系。当表面电位很高时,r趋于1,ER就几乎与δ0无关,而只受电解质浓度与价数的影响。因此添加电解质,微粒周围的电子层被压缩,排斥力减弱,微粒能够在近距离内相互靠近,由于van der Waals引力的作用而实现凝聚。
对于球形粒子,情形要复杂得多,目前只能对几种特定情形求得近似解。例如在kx>>1,即两球形胶体颗粒的重叠程度很小时,其双电层间的排斥能为:Er=64nKT/ki πrr2exp(-kH)
式中,r为离子半径;H为两胶粒之间的最短距离。
这里应该指出的是,上述结论显然是在假定的恒电位表面的情况下得到的,即如果表面电荷是由于电位决定离子在微粒表面上的吸附而形成,那么,当两个微粒相互接近和扩散层相互重叠时,表面电位是不变的,而表面电荷密度要有相应的调整。但如果表面电荷是由于表面物质电离而形成,那么,当两个微粒相互接近和扩散层相互重叠时,表面电荷密度是不变的,而表面电位要有相应的调整。如果粒子间的距离很大,那么上述两种情况下微粒间的相互作用的差别是非常小的。Overbeek曾经研究过这个问题,他的结论是做典型布朗运动的两个微粒互相碰撞时双电层的速度是非常快的,离子不能保持吸附平衡。通常,实际情况是处于表面电位不变和表面电荷密度不变之间的某种状态。
胶体稳定性不仅仅由于静电排斥的结果,往往还与胶体颗粒水化作用有关。DLVO理论尚无法从理论上解决水化作用对胶体稳定的影响。胶体水化作用与胶体种类有关,亲水胶体表面包裹了一层水化膜,水化膜将阻碍两胶粒之间相互聚集;憎水胶体水化作用要弱得多,因此,亲水胶团稳定性主要取决于水化膜而非ζ电位,虽然亲水胶体也存在双电层结构。大量的时间证实,即使亲水胶体的ζ电位降为零,也仍然保持分散稳定状态。而憎水胶体一旦ζ电位降低或消失,水化膜往往也随之同时消除。
- 胶体的异相凝聚
DLVO理论对悬浮液或胶体的凝聚和分散是从同类微粒间的扩散双电层以及van der Waals引力合并在一起考虑的,但对不同种类微粒间的凝聚和分散却超出了它的范围。在异相凝聚中,因微粒不同,一般表面电位也不同,它们的双电层作用力是不对称。对于非对称
双电层重叠的相互作用力,最初是由德里加金(Derjaguin)进行处理。以后由霍格(Hogg)、西利(Healy)和福尔斯特瑙(Feurstenau)等人导出求得双电层相互作用的势能(Vel)公式,以01和02代表两个不同的微粒,其相互作用的势能可用下式表示:
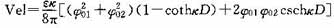
式中,ε为介电常数;δ01和δ02分别为平衡条件下粒子的表面电位;κ为离子层厚度的倒数;D为两微粒之间的距离。
如果δ01=δ02=(在平衡条件下微粒表面电位)时,则其势能与DLVO理论的排斥势能Er相似。由于颗粒表面电位不仅可以在数值上不同,而且还可能异号,因此作用势能Vel可为正值,表现为相斥作用;也可为负值,表现为相吸作用;还可先为正;κ随着距离的接近转正为负。
对介质中异性微粒之间的van der Waals引力来说,如果两个微粒为平板形,则两平板间的吸引势能同式(Ea=-A/12πD2),为:Ea=-A、12πDi
若两个微粒为两个不等球形,则两球间的吸引势能为:Ea=-Ar1r2/3H(r1+r2)
若两个微粒一个为平板型,另一个为球形,则这两个微粒间的吸引势能为:Ea=-Ar/3H
- 影响胶体凝聚的其他因素
胶体的凝聚,除以上因素外还需考虑其他,比如胶体是亲水胶体还是憎水胶体。对于亲水胶体来说,胶体的凝聚的关键是要压缩和去除其周围的结合水化膜。投加电解质可压缩水化膜的厚度,但投加的量比憎水胶体要多。此时首先是中和胶粒所带的电荷,使电动电位降低(与僧水胶体相同),接着是脱水,因离子有很大的水化能力,能夺走胶粒周围的水分子而去除水壳,也即破坏了溶剂化作用,使胶粒脱稳而凝聚。两种亲水胶体间的相互凝聚,必须是所带电荷相异才能发生。另外,离子价数对亲水胶体的凝聚所起的作用很小,甚至没有作用,这一点跟憎水胶体凝聚相比有很大不同。
胶体的凝聚还有一个原因是溶剂化层的影响,在悬浮液中的固体表面有一层溶剂隔膜,具有一定的排列结构。微粒凝聚时、必须使这种排列变形,而引起定向排列的引力倾向于恢复定向排列。这样,溶剂化层就构成了对微粒凝聚时的阻力。因为这些微粒有极大的比表面,故凝聚的阻力也是很大的。
- 巩义市泰和水处理材料有限公司专业生产聚合氯化铝、聚合氯化铝铁、碱式氯化铝、硫酸铝、硫酸亚铁、聚合氯化铝铁、三氯化铁、硫酸铁、各种无机盐类絮凝剂、无机铁盐、铝盐、助凝剂聚丙烯酰胺等净水药剂的专业厂家。
|
|
|
|