| |
联 系 方 式 |
电 话: |
0371-66559606 |
手 机: |
13838271516 |
|
|
PAC产品系列 |
|
|
 |
悬浮物胶体的结构 |
- 胶体的双电层结构
胶体带电的机理可因不同的表面而不同,但从热力学上讲,原因只有一个,那就是因物质的分散度升高而导致了其表面自由焓的升高,为降低自由焓,除了自动缩小界面外,物系还可通过表面发生吸附、离解等达到目的,最终导致胶体表面带上了电荷。通常将决定胶体颗粒表面电荷(或电位)的离子称为“定位离子”或“电位形成离子”,定位离子所在的胶体颗粒表面荷电层称为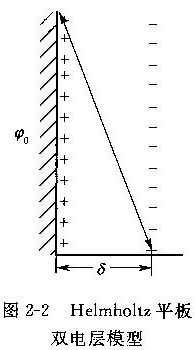 “定位离子层”,表面电荷主要集中在1-2个原子厚度的表面层中。 “定位离子层”,表面电荷主要集中在1-2个原子厚度的表面层中。
胶体表面带电以后,由于静电引力的作用,将吸引溶液中与表面电荷符号相反的离子(反离子),同时反离子也有因热运动以及液体对其的溶剂化作用力而扩散到整个溶液中去的倾向,这两种作用的结果使得靠近胶体表面的反离子过剩(即高于本体溶液华总的浓度),并其浓度随着与胶体表面距离的增加逐渐降低,直到等于溶液中离子的平均浓度。
存在于胶体颗粒表面的电荷与溶液中的反电荷即构成所谓的双电层结构。对于双电层的具体结构,一百多年来不同学者提出了不同的
看法。最早于1879年Helmholz提出平板型模型;1910年Gouy和1913年Chapman修正了平板型模型,提出了扩散双电层模型,后来
Stern又提出了Stern模型。
(1)Helmholz平板型模型
由Helmholtz(1879年)最早提出的双电层结构类似于平板电容器,如图2-2所示。认为固体的表面电荷构成双电层的一层,反离子平行排列在介质中,构成双电层的另一层,两层之间的距离很小,约等于离子半径。在双电层内电位直线下降,表面电位ξ与表面电荷密度a0之间的关系与平板电容器的情形相同:a0=εξο/δ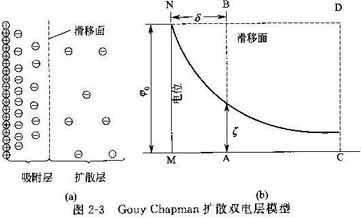
式中δ为两电层之间的距离,ε为介质的介电常数。
根据Helmholtz双电层模型,在外加电场的作用下,带电粒子和溶液中的反离子分别向不同的电极运动。这一模型过于简单,它无法区别表面电位ξο和电动电位ξ后来的研究表明,与粒子一起运动的结合水层厚度远较Helmholtz模型中的双电层厚度大。如果这样,根据Helmholtz模型根本不应该有电动现象发生,因为双电层作为一个整体应该是电中性的。
(2)Gouy-Chapman扩散双电层模型
针对Helmholtz模型中出现的问题,Gouy(1910年)和Chapman(1913年)指出,溶液中的反离子受两个相互对抗的力的作用:静电力使反离子趋向表面,热扩散力使反离子在液相中成均匀分布。两种作用达平衡时,反离子并不是规规矩矩地被束缚于粒子表面附近,而是呈扩散型分布:粒子附近的反离子浓度要大一些,随着离开表面距离的增大,反离子过剩的程度逐渐减弱,同离子不足的程度逐渐减弱,直到某一距离处,反离子与同离子的浓度相等。这样形成了所谓扩散层,其情形如图2-3(a)所示,溶液中的反离子只有一部分紧密地排在固体表面附近,相距约一、二个离子厚度形成吸附层(或紧密层),称为束缚反离子;其他部分反离子由于热运动和液体溶剂化作用而向外扩散,当微粒运动时,其与固体表面脱开而与液体一起运动,它们包围着吸附层形成扩散层,称为自由反离子,扩散层内的反离子分布服从Bolzmann分布。图2-3(b)为双电层中电位变化曲线,图中AB即发生电动现象时,固液之间发生相对移动的实际分界面,称为滑移面,滑移面上的电位即电动电位ξ。可以看出,当固体和液体作相对运动时,滑移面并非在固体表面上,而是在距表面一定距离δ处的AB面上,而滑移面上的电位即电动电位ξ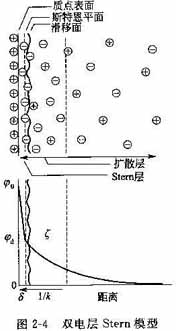 ,亦非表面电位ξο。 ,亦非表面电位ξο。
(3)Stern模型
Gouy-Chapman理论克服了Helmholtz模型的缺陷,区分了ξ电位和表面电位ξο,而且从Poisson-Bol tzman。关系出发,可以得到双电层中电位与电荷分布的定量表达式。但是也有许多实验事实与Gouy-Chapman理论不符,例如根据该模型,ξ电位随离子浓度的增加而减少,但永远与表面电位同号,其极限值为零。而实验表明,有时ξ电位会随着离子浓度的增加变得与原来符号相反,这无法用Gouy-Chapman模型解释。
Stern(1924年)认为,Gouy-Chapman模型的问题在于将溶液中的离子当作了没有体积的点电荷。他提出:①离子有一定大小,离子中心与离子表面的距离不能小于离子半径;②离子与粒子表面之间除静电相互作用外,还有van der Waals吸引作用。
近年来的研究说明,在离子与表面之间还存在所谓“专属作用”,即非静电力,包括共价键、配体交换、氢键等。
根据以上看法,Stern提出,Gouy-Chapman的扩散层还可以再分成两部分。邻近表面的一两个分子厚的区域内,构成所谓固定吸附层或Stern层,其余反离子则扩散地分布在Stern层之外,构成扩散层的扩散部分。在此,Stern层与扩散部分的交界面则构成所谓Stern平面。Stern层内电位变化的情形与Helmholtz平板模型中相似,由表面处ξο的直线下降到Stern平面的ξd,ξd称为Stern电位。在扩散层中电位由ξd降至零,其变化规律服从Gouy-Chapman理论,只需用ξd代替ξο。由以上说明可知,Stern模型实际上是Helmholtz模型与Gouy-Chapman模型的结合,如图2-4所示。
由上文可知,ξ电位是固液相对移动的滑动而与溶液内部的电位差。自Stern模型知,除了Stern层内的离子外,还有一定数量的溶剂分子也与离子紧密结合,在电动现象中作为一个整体运动。因此,滑移面的位置虽然并不知道,但可以认为Stem平面略比滑移面靠里。ξd咧也因此略比ξ电位高.。但只要离子浓度不高,一般情况下均可认为二者相等,不会引起大的误差。
由于Stern层与扩散层中反离子处于平衡,溶液内部离子的浓度或价数增大时,必定有更多的反离子进入Stem层。使得电位下降更快,因而ξ电位会变得更低和扩散层厚度变得更薄。Stern层中的离子不但受到静电力的作用,还可能受到专属力,此两种力可能一致,也可能相反。某些能发生强专属作用的反离子会大量进入Stern层,使表面电荷过渡中和,而使Stern电位反号。当专属力强于静电力时,还可能发生“逆场吸附”,即同号离子会克服静电斥力进入Stern层,使Stern电位高于表面电位。
由于区分了Stern层与扩散层,在Stern层中电位已经由ξο降到了ξd,扩散层中电位不会太高,因此用Boltzmann公式计算离子浓度时,不致得出很不合理的结果。
综上所述,Stern模型较Gouy-Chapman模型又前进了一步,较好地解释了电动现象。但由于定量计算的困难,而且其扩散层部分完全可以沿用Gouy-Chapman理论处理,所以实际应用的多是后者,只是将ξο换成ξd而已。但在Stern模型的基础上,有可能对双电层
的一系列问题做出更加精细的处理。
- 双电层电位
(1)双电层中的电位
①ξο:ξο为荷电的胶体颗粒表面与溶液之间的电位差。ξο无法用实验测得,仅可以测量导体或半导体污染物颗粒电极与另一参比电极(例如标准氢电极或甘汞电极)构成的电池电动势E,通常称为电极电位。显然,电极电位只是欲测电极与参比电极的表面电位的差值,并不是欲测电极ξο本身。但对于导体或半导体胶体颗粒(如金属硫化物颗粒),可将胶体颗粒制成电极测出电极表面电位看做ξο,故又称“电极电位”。对于非导体胶体颗粒,电极电位也无法测量。非导体的胶体颗粒的ξο,只能用间接计算法,先测零电点,然后再用能斯特(Nernst)公式计算对应于任意定位离子浓度的表面电位值。
②ξd:固定吸附层与溶液之间的电位差。
③ζ电位:当胶体颗粒-溶液两相在外力(电场、机械力或重力)作用下发生相对运动时,胶体颗粒表面滑移面上的电位,又称为“移动电位”或“电动电位”。
ζ电位可以用电泳或电渗的速度计算得到:ζ=4πηυ/DE
式中,η为液体的黏滞系数(绝对黏度);υ为液体的移动速度,cm/s;D为液体的介电常数;E为两电极间单位距离的外加电位差,绝对静电单位/cm,其中1绝对静电单位=300V。通常,ζ电位的一般范围为10-200mV,如氢氧化铁溶胶的ζ=56mV;黏土溶胶的ζ=-46.8mV。
(2)零电点和等电点
①零电点:当ξο为零(或表面净电荷为零)时,溶液中定位离子活度的负对数值被定义为“零电点”,用符号PZC(Point of Zero Charge)表示。
应该指出,离子型胶体颗粒在水溶液中,随pH值的变化而影响胶体颗粒的解离,因此在一定的pH值下,ξο会出现为零的情况,此时称该pH值为“零表面电位pH”(或零电点pH)亦区别于该污染物颗粒的PZC。
②等电点:与零电点对应,定义当没有特性吸附,ζ电位等于零时,溶液中定位离子活度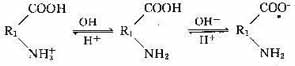 的负对数值为“等电点”,用符号IEP (Isoelectric Point)表示。 的负对数值为“等电点”,用符号IEP (Isoelectric Point)表示。
- 胶团的结构
按以上所述,可以写出胶团的结构式如下:
如果用通式来表示胶团结构,就是:[胶核m·n电位形成离子+(n-x)反离子]x±·x反离子±
式中,m为胶核中的分子数;n为被吸附在胶粒上的电位形成离子数,n-x为吸附层中反离子数;x为扩散层内自由反离子数。
根据这个通式,可以写出各种溶胶的胶团表达式,例如在KBr溶液中带负电的AgBr溶胶其胶团的结构式为:
{[AgBr]m·nBr- + (n-x)K+}x-·xK+ 而在AgNO3溶液中带正电的AgBr胶团的结构式为:
{[AgBr]m·nAg+ + (n-x)NO3-}x+·xNO3 三氯化铁水解得到的氢氧化铁胶团的结构式为:
{[Fe(OH)3]m·nH+ + (n-x)Cl-}x+·xCl- 硅胶溶液的胶团结构式为:{[SiO2]m·nSiO23-* + 2(n-x)H+}2x-·xH+
- 憎水胶体和亲水胶体
①憎水胶体:在吸附层中离子直接与胶核接触,水分子不直接接触胶核的胶体称憎水胶体,其胶核与水分子之间缺乏亲和性。一般无机物的胶体颗粒,如氢氧化铝、氢氧化铁、二氧化硅等都属这一类。憎水胶体具有双电层,其厚度是决定胶体是否稳定的主要因素。
②亲水胶体:胶体微粒直接吸附水分子的胶体称亲水胶体,即胶核与水分子之回有亲和性。亲水胶体的颗粒绝大多数都是相对分子质量都很大的高分子化合物或高聚合物,它们的相对分子质量从几万到几十万,甚至达几百万。一个有机物高分子往往就是一个胶体颗粒,它们的分子结构具有复杂的形式,如线型、平面型、立体型等。亲水胶体直接吸附水分子是由于颗粒表面存在某些极性基团(-OH,-COOH,-NH2等)而引起的。这些基团的电荷分布都是不均匀的,在一端带有较多的正电荷或负电荷,所以称极性基团。极性基团
能吸引许多极性水分子,使得其外围包上一层水化膜,这层水化膜与胶核便组成了胶团。亲水胶体的水化膜厚度是决定胶体是否稳定的主要因素。
与憎水胶体相比,亲水胶体有两点显著不同的地方。一是亲水胶体吸附了大量的水分子,而憎水胶体颗粒表面至多仅吸附一层水分子,水量微不足道,二是亲水胶体能够再吸水并自动分散形成胶体溶液后,可以脱水回复成原来的微粒,并可再吸水重新分散于水中形成胶体溶液。而憎水胶体则不具有这种性质,它们的分散须借外力的作用,脱水后也不能重新自然地分散于水中。亲水胶体也称为可逆胶体,憎水胶体也称为不可逆胶体。亲水胶体保持分散的能力,即稳定性,也比憎水胶体高。
- 巩义市泰和水处理材料有限公司专业生产聚合氯化铝、聚合氯化铝铁、碱式氯化铝、硫酸铝、硫酸亚铁、聚合氯化铝铁、三氯化铁、硫酸铁、各种无机盐类絮凝剂、无机铁盐、铝盐、助凝剂聚丙烯酰胺等净水药剂的专业厂家。
|
|
|
|