| |
联 系 方 式 |
电 话: |
0371-66559606 |
手 机: |
13838271516 |
|
|
PAC产品系列 |
|
|
 |
悬浮物胶体的性质 |
- 胶体的性质
胶体(Collid)这个名间是由英国科学家Thomoas Graham(1861年)提出来的,用来描述扩散速度小,不能透过如羊皮纸一类的半透膜,溶剂蒸发后不结晶而形成无定形胶状物的物质。后来胶体的概念改变为物质的一种分散状态,“胶体”的涵义就是高度分散的意思。胶体与人类生活有着极其密切的联系,江河湖海、城市污水和工业废水是广泛的液溶胶物系。为了保护水源,净化水质,变废为宝,就需要研究胶体物系的形成与破坏,了解胶体颗粒的性能。
- 分散体系及其分类
一种物质的粒子分散到另一种物质中所形成的体系叫做分散体系,其中被分散的物质称为分散相,在分散相周围连续的物质称分散介质。按照分散相粒子的大小,可以把分散体系分为真溶液、胶体溶液和悬浮液三类,它们具有不同扩散速度、膜的通透性和滤纸的通透性能。
(1)真溶液
颗粒直径小于1nm,分散相是原子、离子或小的分子。它的特点是均相,为热力学稳定系统,分散性粒子扩散快,能透过滤纸和半透膜,水溶液呈透明。例如NaOH、NaCl、C6H12O6等水溶液。
(2)胶体溶液
颗粒直径介于1-100nm之间。但对线性的高分子来说,含有10^3-10^9个原子的分子也属胶体颗粒,而不论其绝对尺寸,其分散相是胶粒(分子、粒子或原子的聚集体)、高分子活胶束。它的特点是如果形成溶胶体系,为非均相热力学不稳定系统;如果形成高分子胶
体溶液或缔合胶体溶液,可为均相热力学稳定体系。胶体溶液中的分散相粒子扩散慢,不能透过半透膜,能透过滤纸,例如金溶胶、蛋白质水溶液、核酸水溶液、超过一定浓度的十二烷基硫酸钠溶液等。
(3)悬浮液
颗粒直径大于lOOnm,分散相为粗颗粒,所以悬浮液也称粗分散物系。它的特点是非均相,为热力学不稳定系统,扩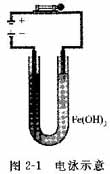 散慢或不扩散,分散相粒子不能透过滤纸和半透膜,水溶液呈浑浊,易发生沉降。例如混浊泥水、牛奶、豆浆等。 散慢或不扩散,分散相粒子不能透过滤纸和半透膜,水溶液呈浑浊,易发生沉降。例如混浊泥水、牛奶、豆浆等。
- 胶体的基本特性
(1)光学性质
胶体颗粒的尺寸很微小,往往由多个分子或一个大分子组成,比可见光的波长小,当光投射时,可引起光的散射;而悬浮液的颗粒尺寸大于可见光波长,只有反射光,没有散射光;真溶液的分散相是分子和粒子,它们的直径很小,对光的散射十分微弱,肉眼无法观察到。胶体的光学性质有一个重要的现象.即丁达尔效应。所谓的丁达尔效应(Tyndall effect)是指在暗室里,如果让一束聚集的光线通过胶体物系,在入射光的垂直方向可看到一个发光的圆锥体。
(2)胶体颗粒的布朗运动
将一束强光透过溶胶并在光的垂直方向用超显微镜观察,可以观测到溶胶中的胶粒在介质中不停地作不规则的运动,称为布朗运动。它是由于某一瞬间胶粒受到来自周围各方介质分子碰撞的合力未被完全抵消而引起的。胶粒质量愈小,温度愈高,运动速度愈高,布朗运动愈剧烈。运动着的胶粒可使其本身不下沉,胶体颗粒的布朗运动是胶体颗粒不能自然沉淀的一个原因。
(3)胶体的电学性质
①电泳现象:在一U形管中放入一种胶体溶液,在两端插入电极,当接通电源后,即可见到胶体颗拉向某一电极逐渐移动,如图2-1所示。胶粒在外加电场作用下的这种移动现象称为电泳。电泳现象说明胶体颗粒是带电的,从电泳的方向可以判断胶粒所带的电荷。大多数金属硫化物、硅酸、金、银等胶粒向阳极迁移,胶体颗粒带负电,称为带负电荷的胶粒;大多数金属氢氧化物胶粒向阴极迁移,胶粒带正电,称为带正电荷的胶粒。研究电泳现象不仅有助于了解溶胶粒子的结构以及电性质,还可以用于研究絮凝,或者在生物化学中用于蛋白质的分离等。
②电渗现象:在电泳同时,也可认为有一部分液体渗透过了胶体颗粒间的孔隙而移向相反的电极。在图2-1中,胶体颗粒在阴极附近浓集的同时,在阳极处的液而得到升高。液体在电场中透过多孔性固体的现象称为电渗。
③流动电位与沉降电位在加压的情况下迫使液体流经静止的固相表面时,在固相的两端会产生电位差,称为流动电位,它是电渗现象的反现象。若是分散相粒子在分散介质中迅速下降,则在液体的表面和底层之间会产生电位差,它是电泳作用的反现象。
电泳与电渗都是由于外加电位差的作用而引起的胶体溶液系统内固相与液相之间产生的相对移动,总称为动电现象。胶体的动电现象证明了胶体粒子是带电的。
(4)胶体的表面性能
在分散体系中,分散度越大,分散相单位体积的表面积,即比表面积越大。例如有一个边长为1m的立方体,它的总表面积为6m2,如将它分割成每边长为1cm的小立方体,此时小立方体的数目将为10^6个,而其总面积将达600m2。胶体颗粒越小,其比表面积越大。具
有很大的表面能,使胶体颗粒产生特殊的吸附能力和溶解现象。
- 胶体带电的原因
胶体颗粒表面总是带有电荷,同时还可吸附溶液中带相反电荷的离子构成胶团。与此同时,离子的热运动又促使这些离子在界面上建立起具有一定分布规律的双电层。胶体颗粒表面带电的原因可能有以下几个方面。
(1)胶核界面的选择性吸附
胶体颗粒中的胶核(原子、离子或分子的聚集体)有吸附其他物质(溶液中电解质的某些阳离子或阴离子)而降低界面自由能的趋势,从而使得胶体颗粒界面带有一定电荷。这种吸附是有选择性的,通常它们优先吸附的是与其有共同成分的那些离子。
例如将FeCl3溶液缓慢滴加到废水中,由氯化铁水解得到氢氧化铁,反应为:
FeCl3+3H20→Fe(OH)3+3HCl
其中HCI为电解质,在水中离解为H+和Cl-
HCI→H+ + Cl-
水解所成的Fe(OH)3分子聚合在一起构成胶体粒子的核心,称胶核。胶核表面吸附与其成分共同的H+,而使其带正电荷。通常认为Fe(OH)3表面的一部分分子和Cl-作用产生氧氯化铁,而氧氯化铁又离解成FeO+与Cl-:
Fe(OH)3+HCl→FeOCl+2H2O
FeOCl→FeO+ + Cl-
这时Fe(OH)3胶核吸附与其组成类似的FeO+而带正电,而胶体中电性相反的Cl-(称反离子)则留在介质中。
又如利用硝酸银和碘化钾制备碘化银溶胶的反应为:AgNO3+KI→AgI+KNO3
改变两种反应物的用量,可使制备的溶胶带有不同符号的电荷,当KI过量时,AgI胶核吸附过量的I-而带负电荷;反之。当AgNO3过量时,AgI胶核则吸附过量的Ag+而带正电荷。
(2)胶核表面分子的离解
一些胶体粒子,在水中本身就可以发生离解,能遣送一种离子到液体中去,而使其本身带电荷。例如,硅胶表面分子与水作用生成H2 SiO3,它是一种弱电解质,在水中可以离解生成SiO23-和H+:
SiO2 + H2O→H2SiO3
H2SiO3→HSiO3- + H+
HSiO3- →SiO23- + H+
H+扩散到介质中去,而SiO23-一则留在胶核表面,结果使胶粒带负电荷。
又如酸性染料(偶氮、蒽醌和酞菁等)等含有磺酸基团与羧酸基团,而这些基团有一部分电离:
-SO3H→-SO3- + H+
-COOH→-COO- + H+
对于两性化合物,其所带电荷与溶液的pH值有关,如Al2(SO4)3水解可得Al(OH)3,当水呈酸性时离解成Al3+和OH-,而当水呈碱性(pH>8)时离解成H+和AlO2-:
Al2(SO4)3+6H2O→2Al(OH)3+3H2SO4
Al3+ + 3OH- →Al(OH)3→H+ + AlO2- +H2O
因此当pH值低时,胶核吸附Al3+而带正电,当pH值高时吸附AlO2-而带负电。
高分子(如蛋白质)含有许多羧基(-COOH)和氨基(-NH2),此类分子也是两性物质,因此在不同的pH条件下带电性不同,当介质的pH值较低时,分子带正电,pH值较高时,带负电。
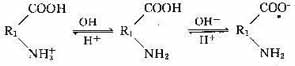
对于两性物质,在某个特定的pH值胶体呈中性,此pH值称为等电点,当pH值大于等电点时胶体带一种电荷,而当pH值小于等电点时则带相反的电荷。
(3)晶格取代
晶格取代也是黏土粒子带电的原因之一。黏土是由氧化铝八面体和硅氧四面体的晶格组成,黏土晶格中的A13+往往有一部分被Mg2+或Ca2+取代,使得黏土晶格带负电。为了保持电中性,黏土粒子表面就会吸附一些正离子,当黏土粒子进入水体时,这些正离子在水中
因水化而离开表面,形成扩散层,使黏土胶粒带负电。
- 巩义市泰和水处理材料有限公司专业生产聚合氯化铝、聚合氯化铝铁、碱式氯化铝、硫酸铝、硫酸亚铁、聚合氯化铝铁、三氯化铁、硫酸铁、各种无机盐类絮凝剂、无机铁盐、铝盐、助凝剂聚丙烯酰胺等净水药剂的专业厂家。
|
|
|
|